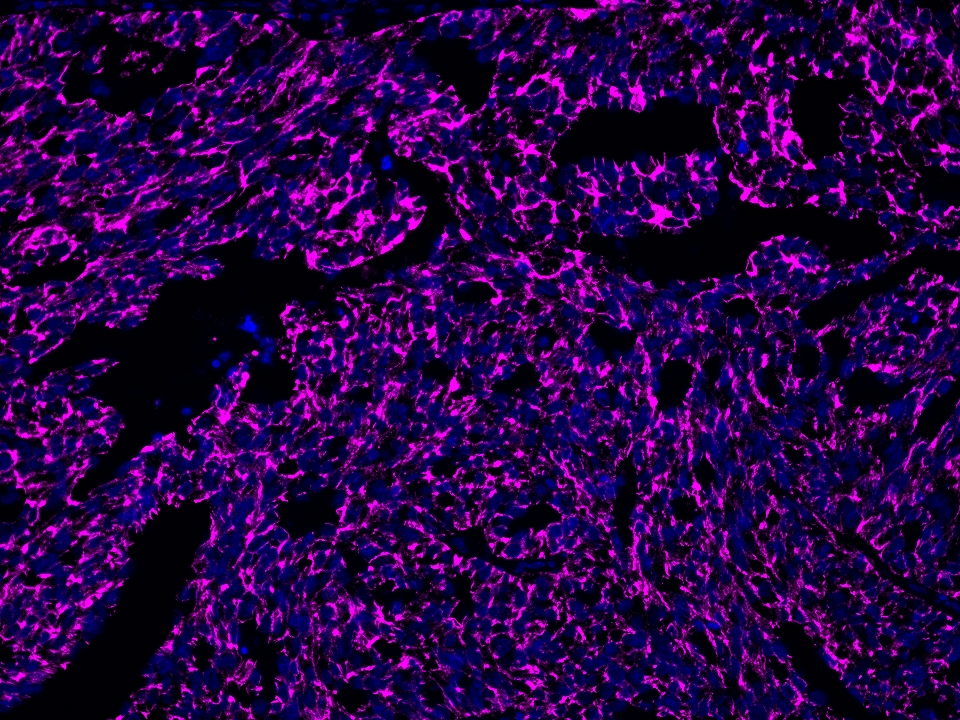
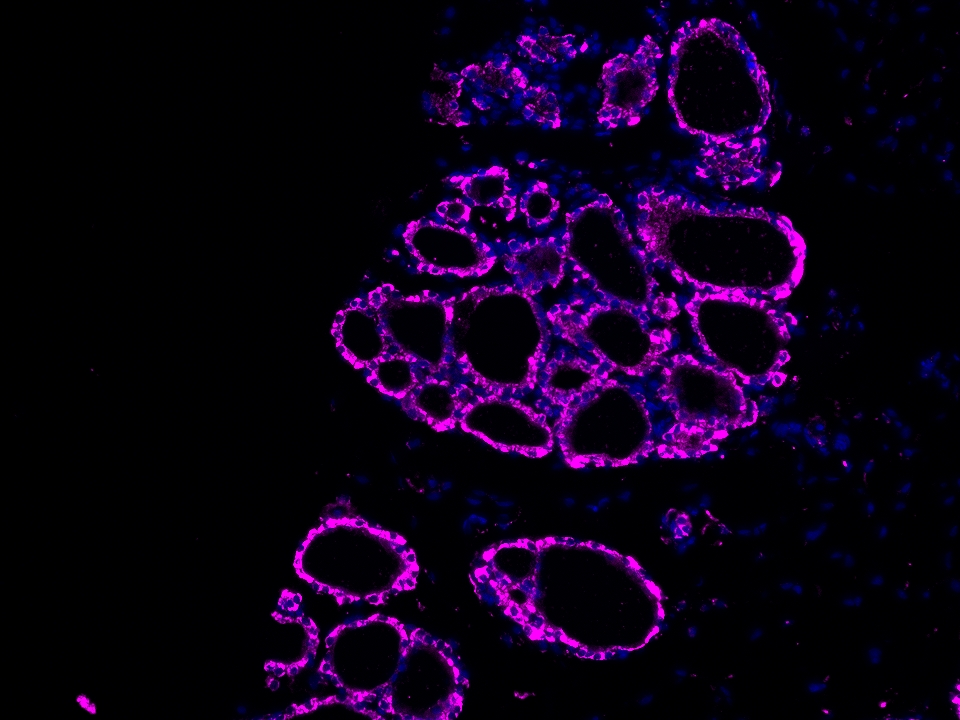
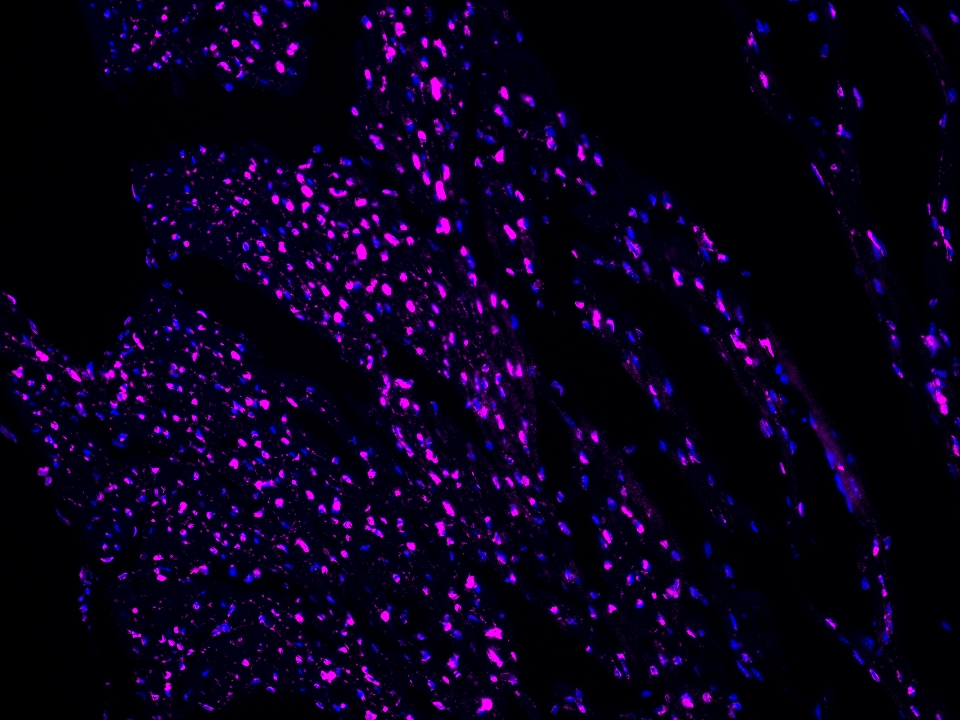
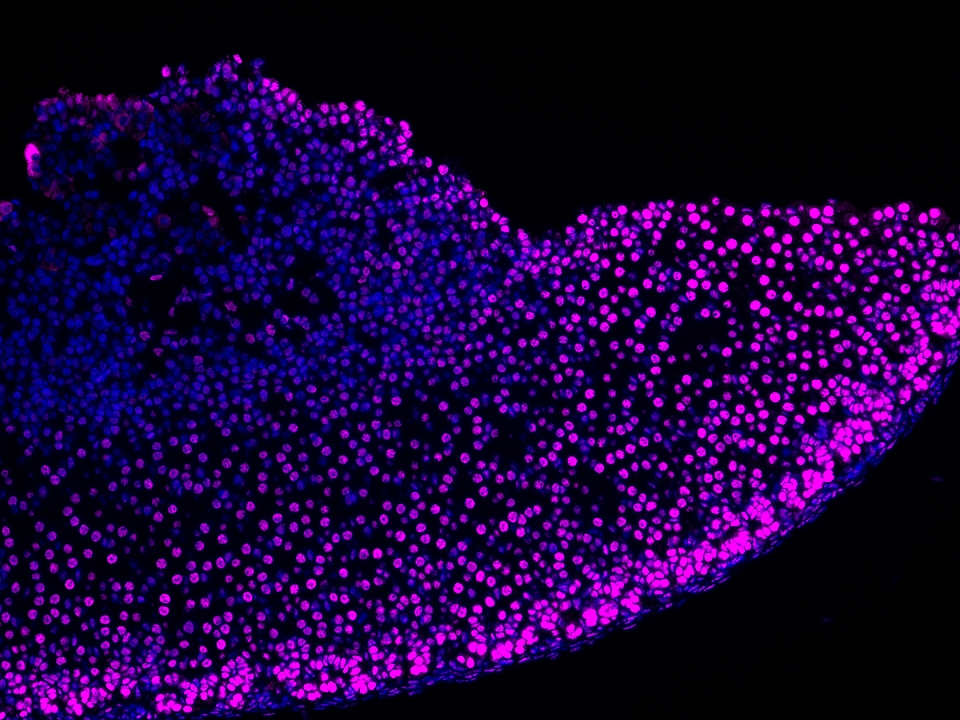
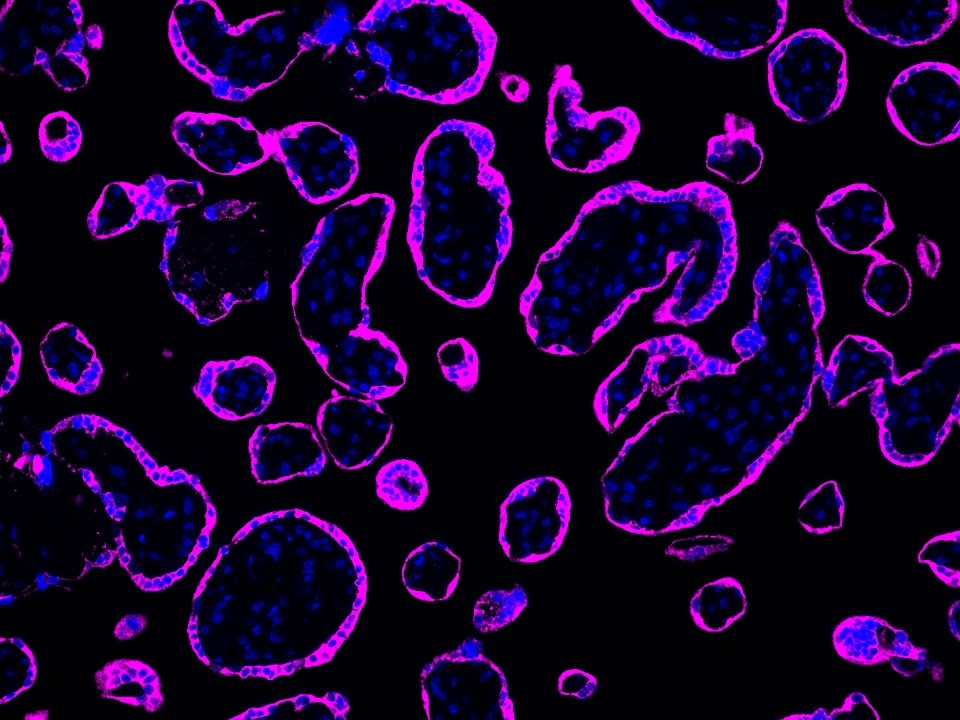
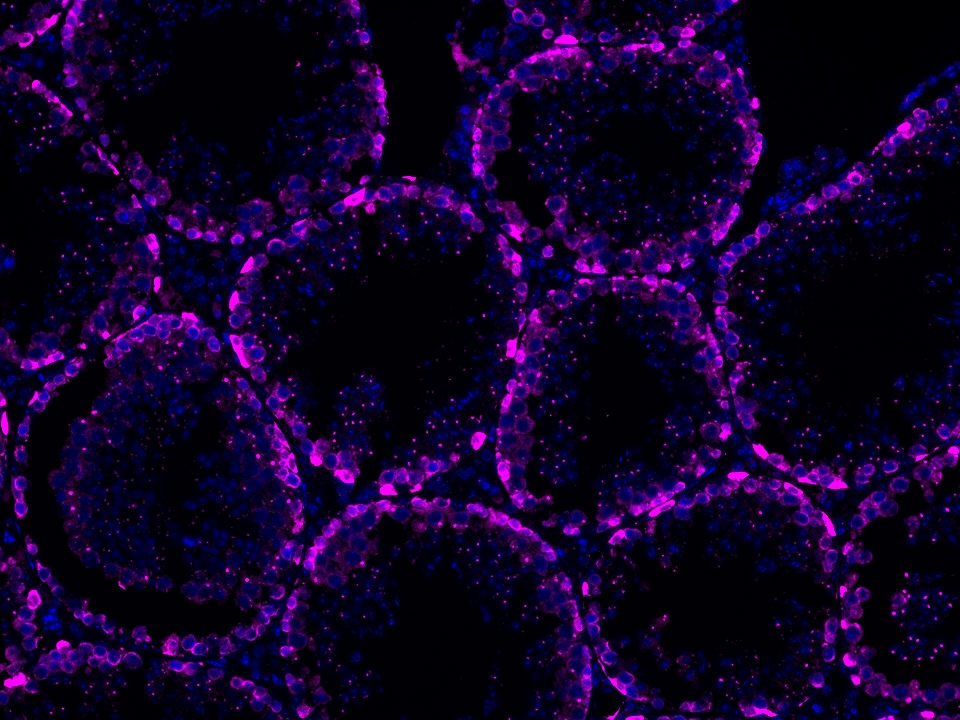
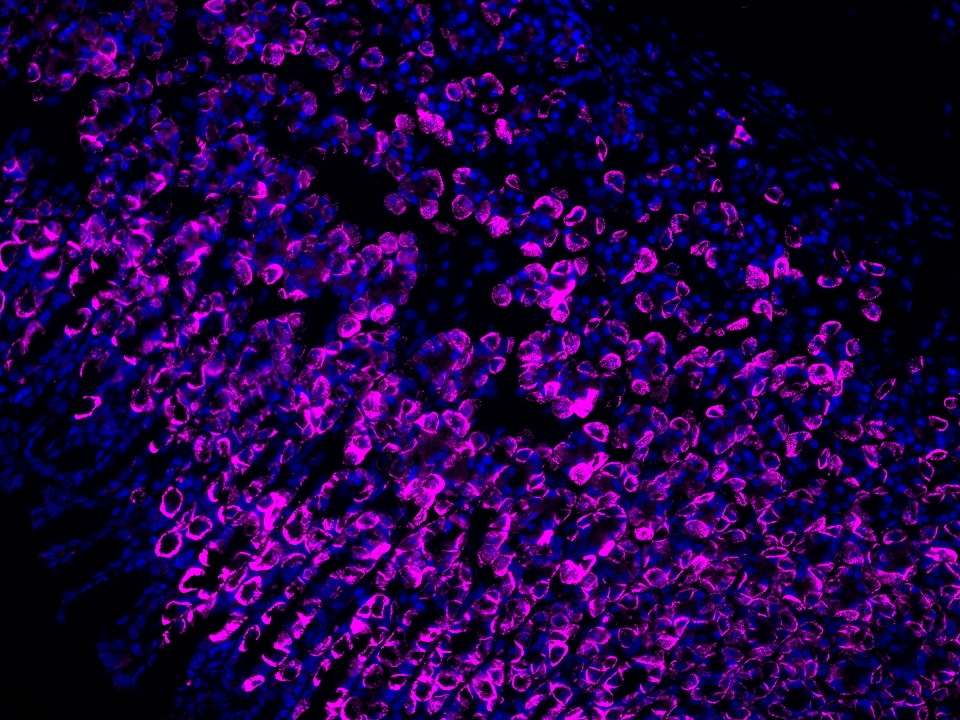
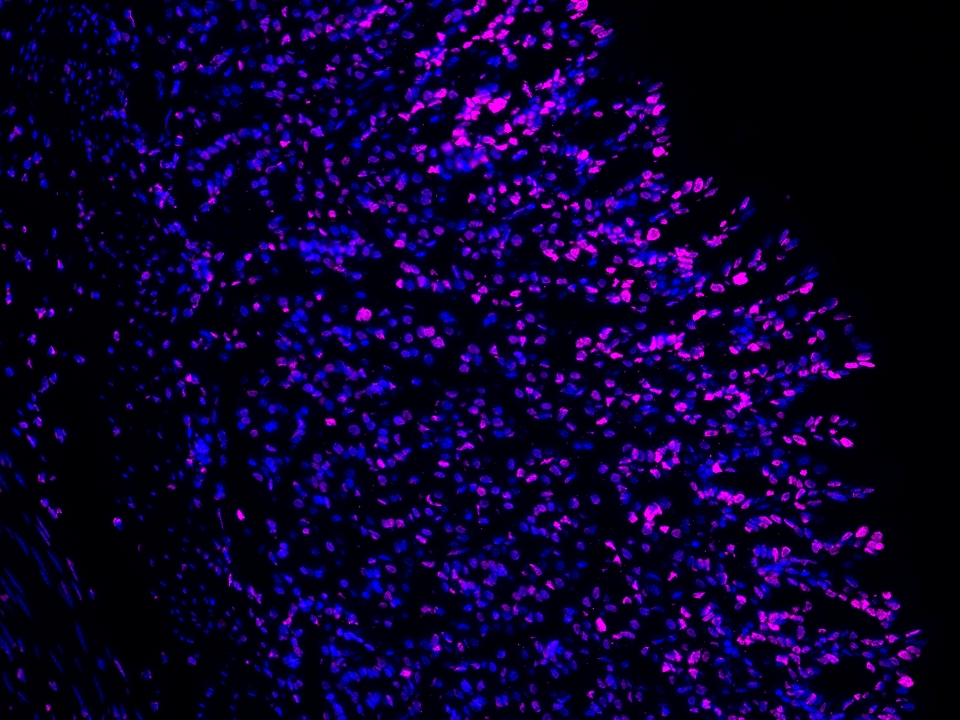
CoraLite®Plus 647-TSA染料
Cat no : PR30025
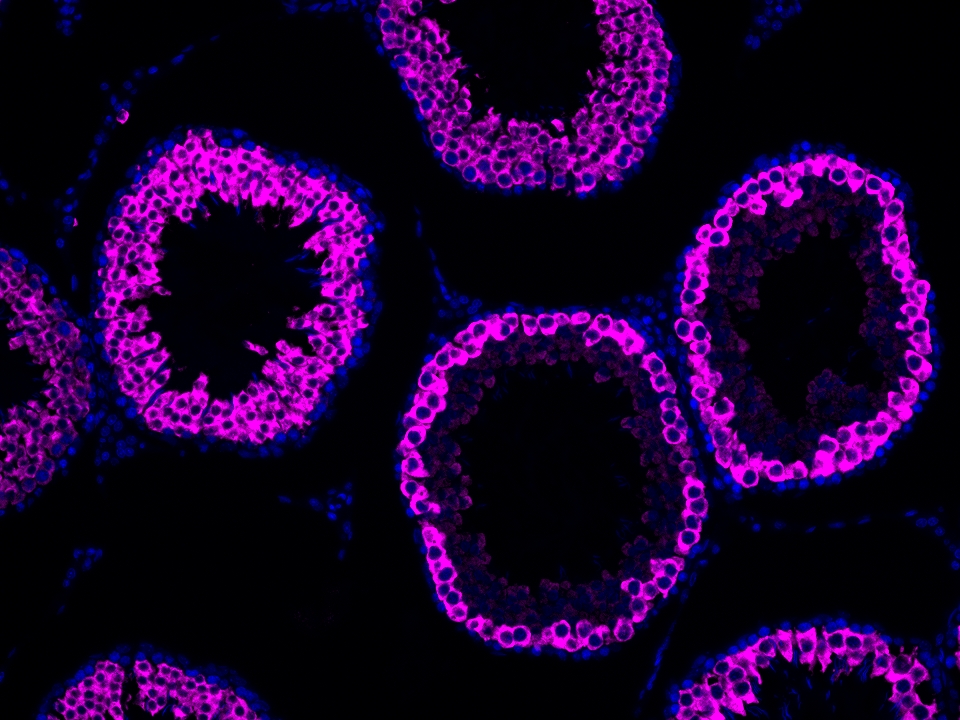
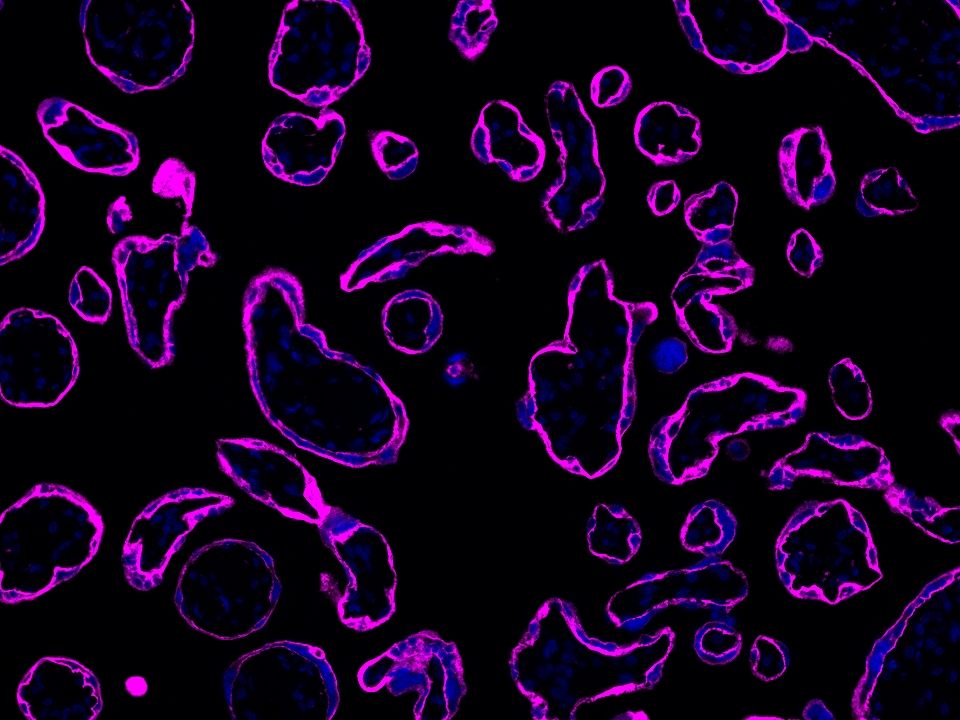
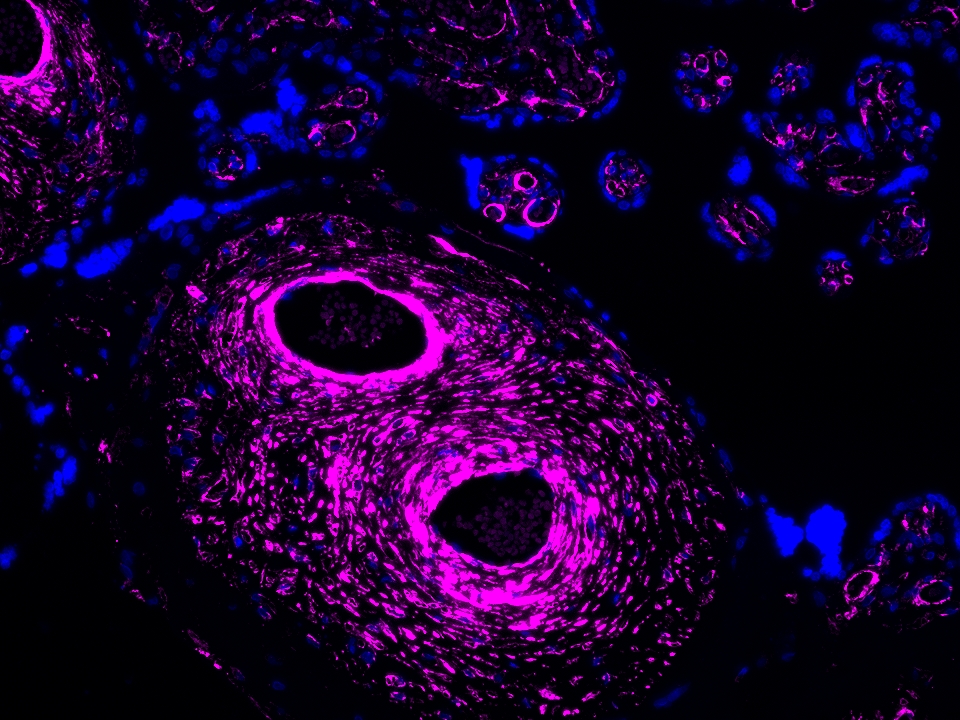
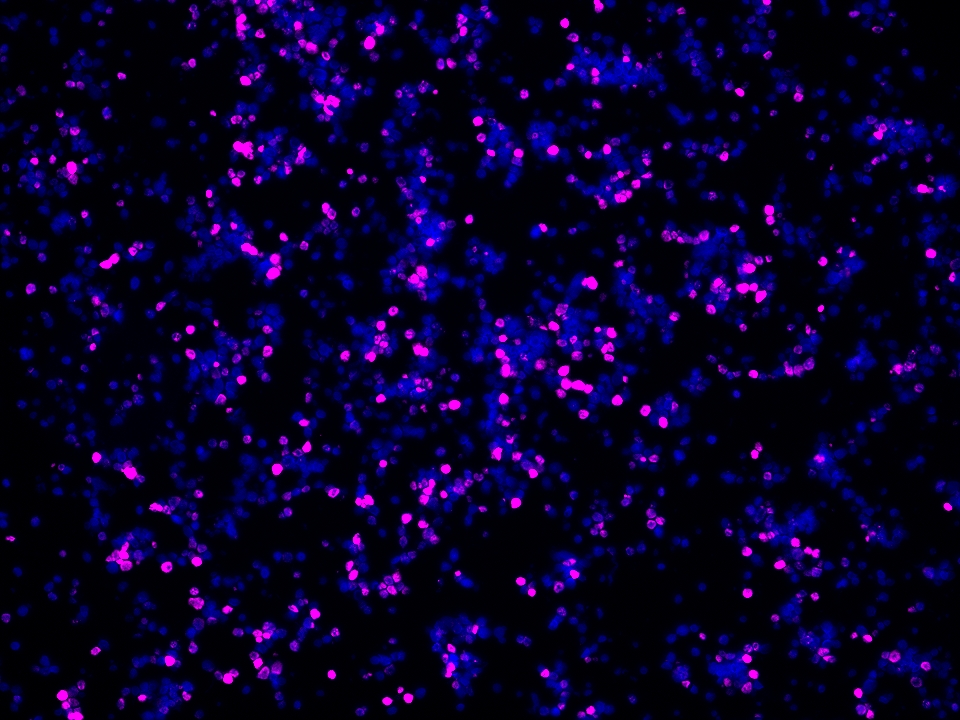
Validation Data Gallery
产品介绍
TSA(Tyramide Signal Amplification)染料是一类基于酪胺信号放大技术的荧光标记试剂。在HRP酶催化下,TSA染料可以与HRP附近蛋白质上的酪氨酸反应形成共价结合并积累,从而可实现信号放大。相比使用直标荧光的一抗或使用荧光二抗进行间接法检测,使用TSA系统可将信号提高数倍至上百倍,加之其与样本形成的共价键稳定不易掉落,因而广泛应用于多重免疫荧光、原位杂交等实验。
本产品为50T规格,包含100 uL CoraLite®Plus 647-TSA染料和5 mL扩增液Amplification Buffer,可以染常规组织切片或细胞爬片约50张/份,注意根据切片大小不同使用次数可能会稍有出入。实验中需要的其他试剂请自行准备或另购。
本产品荧光信号最大激发波长为654 nm,最大发射波长为674 nm,请使用合适配置的成像设备成像。
保存条件
2-8℃保存,有效期12个月。
使用方法
石蜡切片染色
一、 脱蜡
1. 按照常规方法备制组织切片样本。将组织切片样本用不溶于二甲苯和乙醇的笔做好标记,并将切片放进切片篮或染缸架上(务必使用不溶于二甲苯和乙醇的笔作标记,石墨芯铅笔也可)。
2. 将组织切片浸泡在二甲苯中20分钟,然后在另一缸中重复一次。两次二甲苯都用新鲜的。
3. 将组织切片浸泡在100%乙醇中5分钟,然后在另一缸中重复一次。两次乙醇都用新鲜的。
4. 将组织切片依次在下列缸中浸泡 5分钟:
• 95% 乙醇
• 80% 乙醇
• 60% 乙醇
5. 将组织切片用新鲜ddH2O润洗两次,每次1分钟。
二、 抗原修复
按照一抗供应商推荐的方法进行抗原修复,如使用Proteintech一抗,大多情况下均推荐pH 9.0 Tris-EDTA修复,具体方法为:
1. 用电炉将抗原修复液加热至沸腾,减小火力(烧杯上请用锡箔纸盖住,减少液体蒸发)。
2. 将切片篮放入加热好的抗原修复液中,保持95-98℃加热 15-20分钟。
3. 关闭电炉,将烧杯从电炉上取下自然冷却至室温(约35-40分钟)。
三、 灭活和封闭
1. 将切片用ddH2O润洗,使用组化笔在载玻片上围绕组织切片画一个圆圈,切片用ddH2O润洗后再用1x TBST润洗1遍。
2. 灭活(可选):滴加2滴/100 uL Quenching Buffer(通常用3% H2O2)至组织切片上,使液体完全覆盖组织。将切片置于湿盒中室温孵育10分钟。灭活完成后用1x TBST清洗载玻片。
根据我们的经验,大多数情况下不需要对内源性过氧化物酶进行灭活,灭活有时甚至会对染色产生不利影响。然而该步骤在文献中有广泛提及,因此此步骤仅供参考。
3. 封闭:甩干载玻片上的液体,将2滴/100 uL 封闭液(如3% BSA)滴加到载玻片上,覆盖整个组织切片,然后在湿盒中室温封闭30分钟。封闭完成后甩掉载玻片上的封闭液。
四、一抗孵育
1. 使用合适的稀释液稀释一抗。初次实验建议一抗测试几个不同稀释度,摸索时可在一抗浓度为0.1-1 ug/mL附近或者根据免疫组化DAB染色结果设置梯度。将~100 uL(体积取决于组织的大小)稀释的一抗滴加在载玻片上,覆盖整个组织。
2. 在密闭的湿盒中室温孵育1小时(注意组织切片不可变干)。
3. 使用洗瓶冲洗载玻片上的一抗。然后将载玻片浸入1x TBST中3分钟,在新鲜的1x TBST中重复两次洗涤步骤,甩掉多余的洗涤缓冲液。
五、二抗孵育
1. 滴加适量二抗工作液到载玻片上,覆盖整个组织。
为了得到更完美的实验结果,推荐使用Proteintech的重组二抗:
• RGAR011, Multi-rAb® Polymer HRP-Goat Anti-Rabbit Recombinant Secondary Antibody (H+L);
• RGAM011, Multi-rAb® Polymer HRP-Goat Anti-Mouse Recombinant Secondary Antibody (H+L);
2. 湿盒中室温孵育30分钟(注意组织切片不可变干)。
3. 使用洗瓶冲洗载玻片上的二抗。然后将载玻片浸入1x TBST中3分钟,在新鲜的1x TBST中重复两次洗涤步骤,甩掉多余的洗涤缓冲液。
4. 提前将TSA染料和TSA稀释液拿出避光恢复室温。根据实验需要的用量配制TSA工作液体积。配制时,按CoraLite®Plus 647-TSA染料:扩增液Amplification Buffer=1 : 50进行混合即得到TSA工作液。
六、TSA染料孵育
1. 二抗洗涤完成后,将TSA工作液滴加在载玻片上,确保覆盖整个组织。
2. 在密闭的湿盒中室温避光孵育10分钟。
3. 用ddH2O冲洗载玻片上的TSA染料,将切片用新鲜ddH2O润洗2遍。
如需进行多重染色,按第七步方法进行。如只染单色,请跳至第八步。
七、多重染色
1. 染完一轮后进行抗原修复:使用1x Tris-EDTA抗原修复液加热修复,操作同第二步骤。注意修复中防止液体沸腾产生气泡,否则容易脱片。
2. 抗原修复完成后,重复第三到六步骤,完成第二轮抗体染色。
3.重复第二到六步骤,依次完成多轮抗原修复-封闭-一抗-二抗-TSA染色步骤。中途如需暂停实验,建议染色完TSA后,用新鲜ddH2O浸泡组织切片,避光4℃存放。
八、细胞核染色
1. TSA染色完成后,用新鲜ddH2O冲洗载玻片上的TSA染料,将切片用新鲜ddH2O润洗2遍。再将切片用1x TBST润洗1遍,将~100 uL(体积取决于组织的大小)DAPI染料滴加在载玻片上,覆盖整个组织。
2. 在密闭的湿盒中室温避光孵育10分钟。
3. 用ddH2O冲洗载玻片上的DAPI染料,将切片用新鲜ddH2O润洗2遍。
九、 封片和结果观察
1. 封片:切片在避光处自然晾干,滴加1滴封片剂到组织切片上,小心将盖玻片盖在组织和封片剂上,确保组织被封片剂完全覆盖,避免产生气泡。
2. 结果观察:用荧光显微镜或其他成像设备观察和分析染色结果。
冰冻切片染色
一、 将制备好的冰冻切片拿出恢复室温。
二、 抗原修复(可选)
根据一抗供应商推荐决定是否需要修复,针对无需修复的一抗可跳过本步骤。具体修复方法按一抗供应商推荐条件进行。
三、 封闭
1. 将切片用ddH2O润洗,使用组化笔在载玻片上围绕组织切片画一个圆圈,切片用ddH2O润洗后再用1x TBST润洗1遍。
2. 封闭:甩干载玻片上的液体,将2滴/100 uL 封闭液(如3% BSA)滴加到载玻片上,覆盖整个组织切片,然后在湿盒中室温封闭30分钟。封闭完成后甩掉载玻片上的封闭液。
四、一抗孵育
1. 使用合适的稀释液稀释一抗。初次实验建议一抗测试几个不同稀释度,摸索时可在一抗浓度为0.1-1 ug/mL附近或者根据免疫组化DAB染色结果设置梯度。将~100 uL(体积取决于组织的大小)稀释的一抗滴加在载玻片上,覆盖整个组织。
2. 在密闭的湿盒中室温孵育1小时(注意组织切片不可变干)。
3. 使用洗瓶冲洗载玻片上的一抗。然后将载玻片浸入1x TBST中3分钟,在新鲜的1x TBST中重复两次洗涤步骤,甩掉多余的洗涤缓冲液。
五、二抗孵育
1. 滴加适量二抗工作液到载玻片上,覆盖整个组织。
为了得到更完美的实验结果,推荐使用Proteintech的重组二抗:
• RGAR011, Multi-rAb® Polymer HRP-Goat Anti-Rabbit Recombinant Secondary Antibody (H+L);
• RGAM011, Multi-rAb® Polymer HRP-Goat Anti-Mouse Recombinant Secondary Antibody (H+L);
2. 湿盒中室温孵育30分钟(注意组织切片不可变干)。
3. 使用洗瓶冲洗载玻片上的二抗。然后将载玻片浸入1x TBST中3分钟,在新鲜的1x TBST中重复两次洗涤步骤,甩掉多余的洗涤缓冲液。
4. 提前将TSA染料和TSA稀释液拿出避光恢复室温。根据实验需要的用量配制TSA工作液体积。配制时,按CoraLite®Plus 647-TSA染料:扩增液Amplification Buffer=1 : 50进行混合即得到TSA工作液。
六、TSA染料孵育
1. 二抗洗涤完成后,将TSA工作液滴加在载玻片上,确保覆盖整个组织。
2. 在密闭的湿盒中室温避光孵育10分钟。
3. 用ddH2O冲洗载玻片上的TSA染料,将切片用新鲜ddH2O润洗2遍。
如需进行多重染色,按第七步方法进行。如只染单色,请跳至第八步。
七、多重染色
1. 染完一轮后用重生液(Stripping Buffer)脱去切片上一抗和二抗。
2. 重复第三到六步骤,完成第二轮抗体染色。
3. 重复第三到七步骤,依次完成多轮重生-封闭-一抗-二抗-TSA染色步骤。中途如需暂停实验,建议染色完TSA后,用新鲜ddH2O浸泡切片,避光4℃存放。
八、细胞核染色
1. TSA染色完成后,用新鲜ddH2O冲洗载玻片上的TSA染料,将切片用新鲜ddH2O润洗2遍。再将切片用1x TBST润洗1遍,将~100 uL(体积取决于组织的大小)DAPI染料滴加在载玻片上,覆盖整个组织。
2. 在密闭的湿盒中室温避光孵育10分钟。
3. 用ddH2O冲洗载玻片上的DAPI染料,将切片用新鲜ddH2O润洗2遍。
九、 封片和结果观察
1. 封片:切片在避光处自然晾干,滴加1滴封片剂到组织切片上,小心将盖玻片盖在组织和封片剂上,确保组织被封片剂完全覆盖,避免产生气泡。
2. 结果观察:用荧光显微镜或其他成像设备观察和分析染色结果。
细胞样本染色
一、 固定
1. 弃去细胞培养基,向细胞爬片或培养板中加入足量(爬片~100 uL/张,96孔板50 uL/孔,下同)1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
2. 向细胞上加入足量固定液,室温固定15分钟。请根据一抗厂家推荐使用合适的固定液。进行多重染色时,确保使用的固定液可兼容所有一抗。
3. 弃去固定液,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
二、 通透和封闭
1. 通透:向细胞上加入足量通透液(如0.2% Triton X-100),室温通透5分钟。弃去通透液,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
2. 封闭:向细胞上加入足量封闭液(如3% BSA)。室温封闭30-60分钟。封闭结束后甩干封闭液。
三、 一抗孵育
1. 使用合适的稀释液稀释一抗。初次实验建议一抗测试几个不同稀释度,摸索时可在一抗浓度为0.1-1 ug/mL附近或者根据此一抗免疫组化DAB染色条件附近设置梯度。
2. 向细胞上加入足量一抗工作液,37℃孵育1小时或者室温孵育2小时。
3. 弃去一抗,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
四、 二抗孵育
1. 滴加适量二抗工作液到细胞上,确保覆盖全部细胞区域,室温孵育30分钟。
为了得到更完美的实验结果,推荐使用Proteintech的重组二抗:
• RGAR011, Multi-rAb® Polymer HRP-Goat Anti-Rabbit Recombinant Secondary Antibody (H+L);
• RGAM011, Multi-rAb® Polymer HRP-Goat Anti-Mouse Recombinant Secondary Antibody (H+L);
2. 弃去二抗,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
3. 提前将TSA染料和TSA稀释液拿出避光恢复室温。根据实验需要的用量配制TSA工作液体积。配制时,按CoraLite®Plus 647-TSA染料:扩增液Amplification Buffer=1 : 50进行混合即得到TSA工作液。
五、TSA染料孵育
1. 二抗洗涤完成后,将TSA工作液滴加在细胞上,确保覆盖所有细胞区域。室温避光孵育10分钟。
2. 弃去染料,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。
如需进行多重染色,按第六步方法进行。如只染单色,请跳至第七步。
六、多重染色
1. 染完一轮后用重生液(Stripping Buffer)脱去细胞上的一抗和二抗。
2. 重复第三到五步骤,完成第二轮抗体染色。
3. 重复第三到六步骤,依次完成多轮重生-封闭-一抗-二抗-TSA染色步骤。中途如需暂停实验,建议染色完TSA后,用新鲜PBS浸泡细胞样本,避光4℃存放。
七、 细胞核染色
1. 向细胞上加入适量DAPI染料,室温避光孵育10分钟。
2. 弃去DAPI,用足量1× PBS清洗细胞,3分钟/次,甩干洗液,重复两遍。根据成像设备拍摄兼容的模式,选择封片后观察,或向细胞上加PBS后直接观察。
八、结果观察
结果观察:用荧光显微镜或其他成像设备观察和分析染色结果。
注意事项
1. 如需进行多重染色,一般建议先染低丰度靶标或弱抗体,如配合Proteintech TSA染料,建议配色顺序为:555-488-594-647。同时由于CoraLite®Plus 555-TSA和CoraLite®Plus 594-TSA波长接近,容易出现串色,建议CoraLite®Plus 555-TSA和CoraLite®Plus 594-TSA搭配弱阳性一抗。
2. 如进行多重染色,建议先单染摸索不同靶标的最适条件后再进行多重染色以减少不必要浪费和方便分析结果。
3. 操作过程中,任何步骤往样本上加液时,请确保液体中没有气泡,否则会形成空斑等异常着色。加液时,注意避免刮擦组织。
4. 实验中注意操作的连续性,操作中途防止组织切片或细胞样本变干。