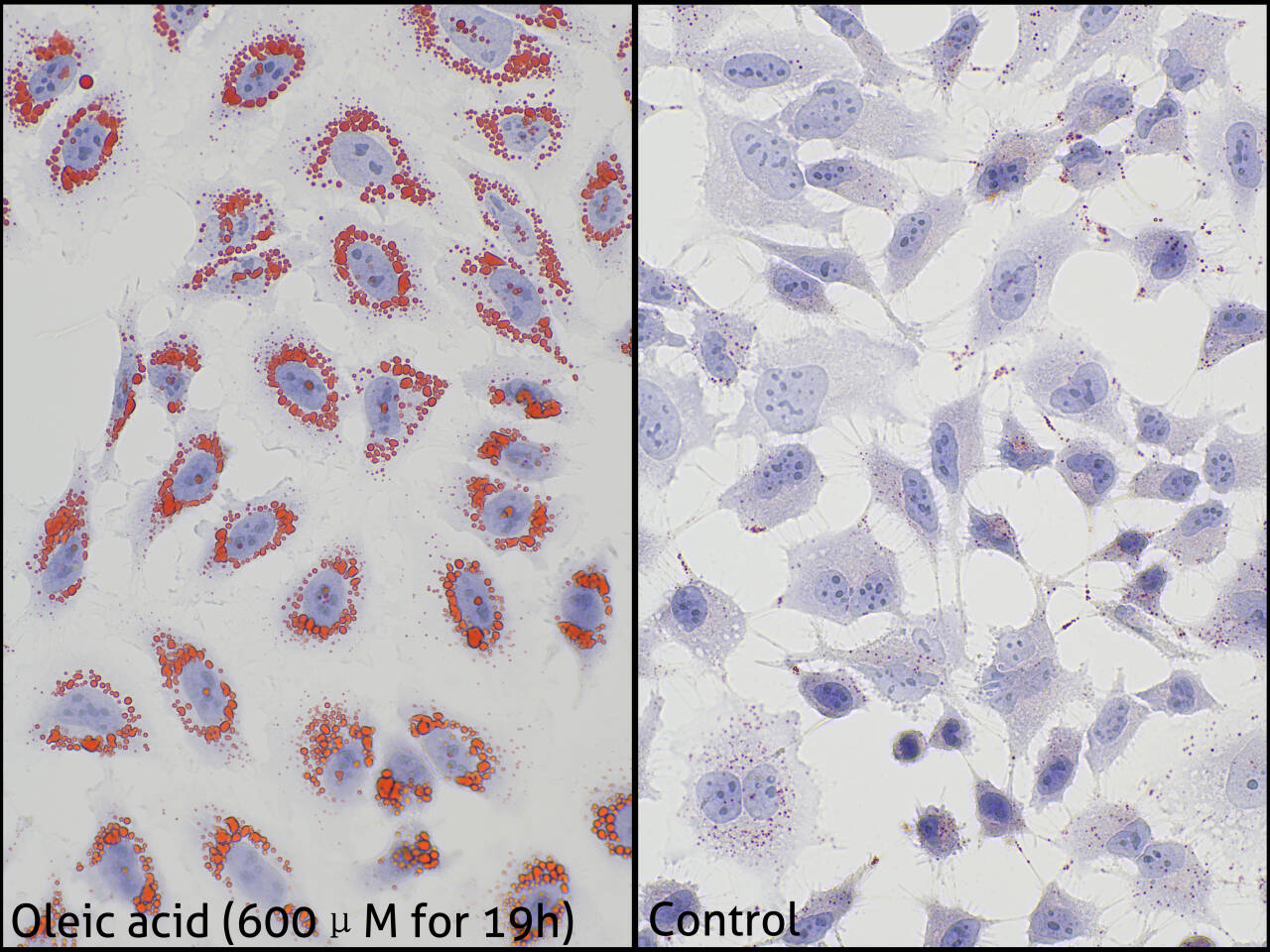
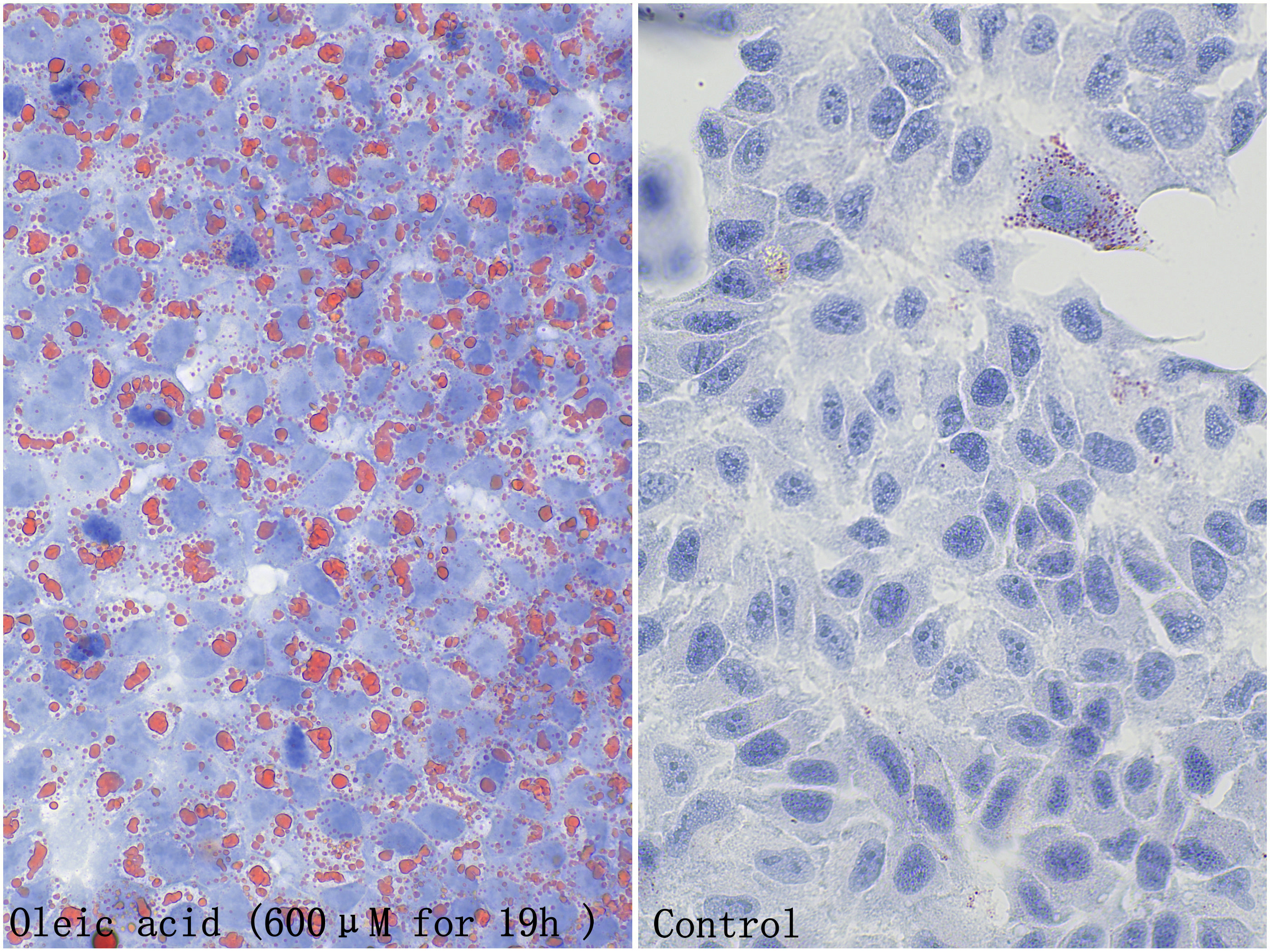
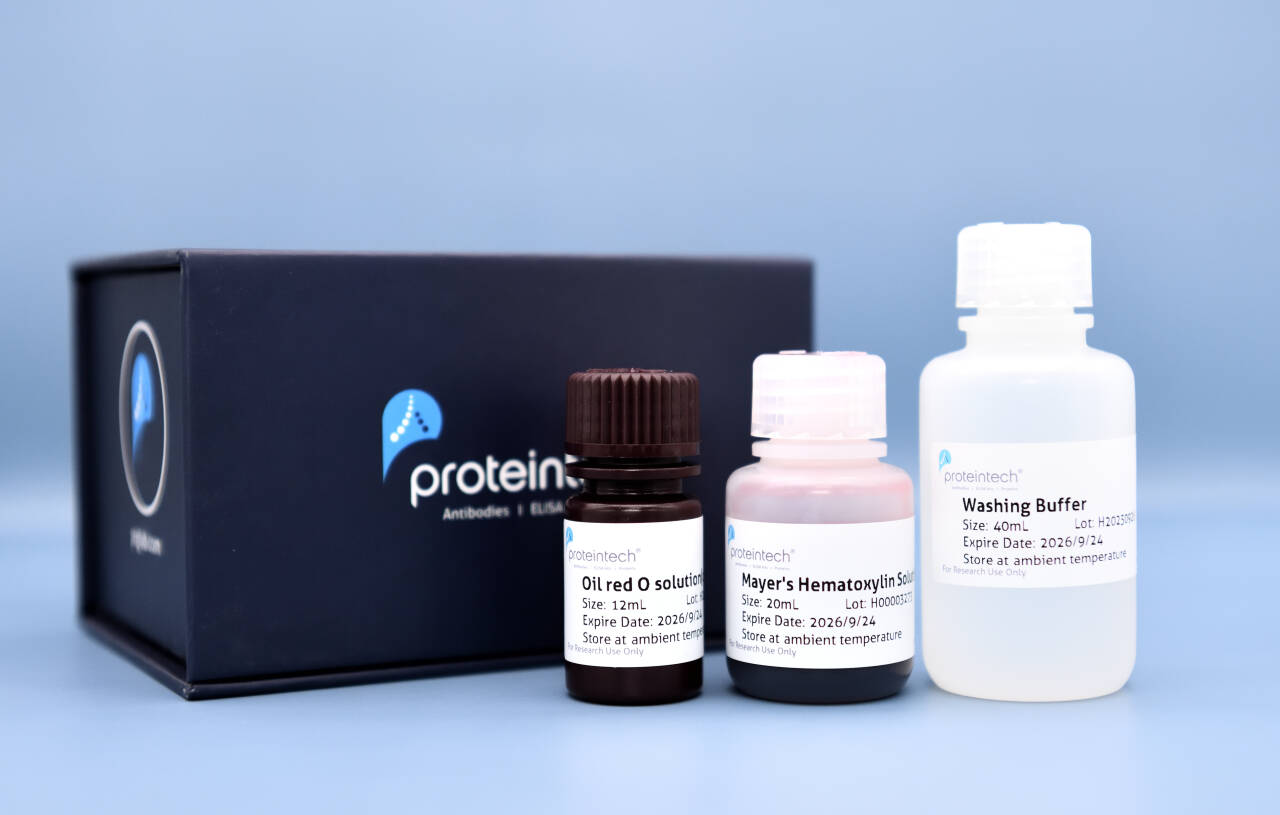
Validation Data Gallery
Product Information
油红O是一种脂溶性重氮染料,能特异性地使细胞或组织内甘油三脂等中性脂质染色,而对磷脂和类固醇等染色较弱。本产品可用于脂肪相关研究,可将细胞内生成的脂滴或组织内的甘油三脂等中性脂质染成红色或橙红色,同时本产品还包含苏木素组份,可以对细胞核进行复染而使细胞核呈蓝色以便观察。
本产品染色清晰,存储稳定。 适用于细胞、组织冰冻切片。而石蜡切片因在样本处理过程中脂质大量损失因而难以被检测到。
产品介绍
本产品为200 T规格,可以染常规组织切片或细胞爬片约200张/份,染96孔板内细胞约400孔。注意根据切片大小不同或使用不同孔板,使用次数可能会有出入。主要组成见下表,其他未提供的试剂请自备。
组分 | 规格 |
油红O溶液(浓缩型)Oil Red O Solution (Concentrated) | 12 mL |
染色洗涤液 Washing Buffer | 40 mL |
苏木素染色液 Mayer's Hematoxylin Solution | 20 mL |
保存条件
室温避光保存,一年有效。
使用方法
1. 油红O染色工作液制备
实验前根据样品数量及每个样品所需的染色工作液的体积,按照本试剂盒中提供的油红O溶液Oil Red O Solution (Concentrated)和ddH2O(自备)以3:2的比例配制油红O染色工作液。例如需配制10 mL油红O染色工作液Oil Red O Solution (Concentrated),则取6 mL油红O溶液,加入4mL ddH2O混匀。
2. 油红O染色
a. 细胞样本
1) 缓慢去除爬片或孔板中的细胞培养液,PBS洗涤1次。注意此步骤中的PBS请自备,不得使用试剂盒中的染色洗涤液,下同。
2) 细胞用4%多聚甲醛固定液固定10分钟,弃去固定液,PBS洗涤2次。
3) 向细胞上加入适量本试剂盒中提供的染色洗涤液Washing Buffer,静置20秒。注意液量确保覆盖全部细胞(96孔板约50 uL /孔,24孔板约200 uL/孔,6孔板约300 uL/孔,直径1 cm爬片约100 uL/片,下同)。
4) 弃去染色洗涤液,加入适量准备好的油红O染色工作液均匀覆盖细胞,染色5-15分钟。
5) 弃去油红O工作液,用染色洗涤液Washing Buffer洗涤分化5-20秒,再用PBS洗3次。
6) 加入本试剂盒中提供的苏木素染色液Mayer's Hematoxylin Solution,覆盖细胞2分钟。
7) 弃去苏木素染色液,加入PBS,浸泡5分钟,缓慢返蓝。
8) 显微镜下观察。
b. 冰冻切片
1) 取出预制好的冰冻切片,放入切片架回温5-10分钟。
2) 滴加适量本试剂盒中提供的染色洗涤液Washing Buffer,完全覆盖切片静置20秒。
3) 去除染色洗涤液,滴加适量准备好的油红O染色工作液,染色5-15分钟。
4) 去除油红O工作液,用染色洗涤液Washing Buffer洗涤分化5-20秒,PBS冲洗3次。
5) 加入本试剂盒中提供的苏木素染色液Mayer's Hematoxylin Solution,覆盖组织2分钟。
6) 用PBS浸泡5分钟,缓慢返蓝,ddH2O冲洗。
7) 用ddH2O或水性封片剂(Proteintech货号PR30005)封片,显微镜下观察。
注意事项
1. 本试剂盒中油红O溶液(浓缩型)室温保存时,可能会有少量沉淀析出或瓶壁有少量不溶物粘附,不影响使用。
2. 油红O染色工作液放置一段时间易产生沉淀,配制后最好在60分钟之内使用。
3. 样品固定时请使用4%多聚甲醛固定液或10%甲醛溶液,不可用醇类或丙酮等可以溶解脂肪的固定液。
4. 用于油红O染色的冰冻切片要适当厚一些,一般为10-15 um,切片太薄容易导致脂肪流失。
5. 油红O染色结果不能长期保存,染色完毕后应尽快观察拍照。
6. 为了您的安全和健康,请穿实验服并戴一次性手套操作。