1、细胞样品
a、瓶内裂解法(效果最佳):适用于所有的贴壁细胞
(1)吸净培养基,用冰的PBS清洗细胞表面2遍(动作轻柔,防止细胞脱落),尽可能吸取残留的PBS。
(2)在冰上按每1000万细胞加入1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物)于细胞瓶、培养板或培养皿中,用移液管吹散贴壁的细胞,对于贴壁紧的细胞也可使用细胞刮收集,收集裂解液,在冰上放置30 min,期间每10 min上下颠倒混匀一次。
b、离心法:适用于悬浮细胞和药物处理过的细胞
(1)使用细胞刮收集细胞悬液(连同培养基一起收集),4℃,500 g离心5 min,收集沉淀,沉淀用预冷的PBS洗涤两遍,收集细胞沉淀,尽可能吸取残留的PBS。
(2)按每1000万细胞加入1 mL预冷的裂解液,在冰上放置30 min,期间每10 min上下颠倒混匀一次。
注:
①细胞的收集优先使用瓶内裂解法处理,瓶内裂解法可以有效的防止细胞在离心过程中破碎,能有效地提高总蛋白得率,同时也能保留细胞外基质(ECM)。
②对于药物处理过的贴壁细胞则推荐使用离心法收集,因为药物处理过的细胞往往贴壁不牢,在PBS清洗阶段容易丢失。
③不推荐使用胰酶消化,胰酶消化细胞不仅会造成细胞外基质(ECM)的完全丢失,同时会剪切一些对胰酶敏感的蛋白,从而在WB检测时经常可以检测到消化出来的短片段而误以为是杂带如下图:

④一些细胞粘度高(HEK-293)和密度高的悬浮细胞(Jurkat、K562等)在加入细胞裂解液后容易形成絮状物,此时应及时的使用超声破碎仪将其打散。
2、组织样本
a、采集与保存:
(1)采集组织样本前先对动物去除血液(血液去除越干净越好),接着迅速解剖,采集所需要的组织样本。
(2)组织样本如需保存,可将采集的组织样本液氮速冻,然后转移至-80℃保存。
(3)取样顺序:最先取胃肠道消化系统相关组织,接着取肺(巨噬细胞含量高)、肝脏(蛋白种类多)、膀胱、生殖系统相关的组织(睾丸、卵巢、子宫、输卵管等),最后取心脏、脾脏、肾脏、骨骼肌、大小脑等组织。
b、清洗
(1)对于血液含量丰富的组织样本如:心脏、肝脏、脾脏、肺、肾脏等组织,剪碎使用冰的PBS洗涤液清洗2-3遍(可以适当按压排出血液),直至样本血红色变浅,滤纸吸干水分称重。
(2)对于脂肪含量丰富的组织样本,预先把样本放在几层纸巾上按压,去除部分脂类,然后再使用冰的PBS清洗1-2遍,滤纸吸干水分称重。
c、破碎及裂解
(1)液氮研磨法:将剪碎的组织块在研钵中加入液氮,快速研磨至细粉状,转移至EP管中,按每100 mg组织加1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物),使用移液器上下吹打混匀,直至完全溶解。在冰上放置30 min,期间每10 min上下颠倒混匀一次。
(2)匀浆法:按每100 mg组织加1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物),将样品转移到合适大小的预冷玻璃匀浆器中,在冰浴条件下对样品匀浆30-50次。在冰上放置30 min,期间每10 min上下颠倒混匀一次。
注:不同的样品所需匀浆次数不同。鉴定方法:取20 ul匀浆30次后的组织样品,加入等体积的0.4%台盼蓝溶液,混匀,在显微镜下观察台盼蓝溶液染色阳性(蓝色)细胞数目的比例,当阳性(蓝色)细胞完全破碎,即可停止匀浆。若阳性(蓝色)细胞破碎不完全,则可适当增加5-10次匀浆,随后按照同样的方法使用台盼蓝溶液进行鉴定。
(3)冷冻研磨机法:提前开启冷冻研磨机预冷,将吸干水分的组织样本剪成1-2 mm左右的小块,按照每管100 mg分装到2 mL离心管,同时每管加入1粒5 mm的研磨珠。将离心管和适配器放入液氮里浸泡速冻。将离心管和适配器转移到冷冻研磨机,使用65 Hz研磨45s,如果研磨效果不理想可中断15s后重复研磨一次。每管加1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物),使用移液器上下吹打混匀,直至完全溶解。在冰上放置30 min,期间每10 min上下颠倒混匀一次。
注:
①优先推荐选用液氮研磨法和冷冻研磨机法,其破碎效果最佳;如选用匀浆法,需在冰水浴中对样品进行匀浆。
②使用冷冻研磨机法对液氮速冻过的样本进行破碎,对离心管的材质要求比较高,需选用专用的离心管。
3、昆虫样本
将昆虫清洗干净,使用液氮研磨法、匀浆法或冷冻研磨机法(参考组织样本的破碎及裂解方法)将其破碎,按每50-100 mg样本加1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物),在冰上放置30 min,期间每10 min上下颠倒混匀一次。
4、植物样本
将植物清洗干净,使用液氮研磨法或冷冻研磨机法(参考组织样本的破碎及裂解方法)将其破碎(越碎越好),按每100-200 mg样本加1 mL预冷的裂解液(使用前添加新鲜的蛋白酶抑制剂混合物),在冰上放置30 min,期间每10 min上下颠倒混匀一次。
注:植物样本不推荐使用匀浆法,液氮研磨法或冷冻研磨机法中液氮对破碎植物的细胞壁有非常好的效果。
5、超声处理
将裂解的蛋白样品放在冰上超声破碎,200W,2 min(开2s,关2s),充分打断核酸序列(用于Co-IP实验的样品不要对样品进行超声波处理)。超声破碎不仅可以起到破碎膜结构,而且还能打断核酸序列、降低样品粘度,对最终WB结果有关键性作用(见下图)。

6、样品的使用与保存
6.1 用于免疫沉淀、ELISA等非变性蛋白分析实验,4℃,10000 g离心5 min分离上清,取部分样品用来测浓度,剩下的蛋白样品可直接分成数管保存在-20℃或-80℃。
6.2 用于免疫印迹的变性蛋白分析实验,取部分样品用来测浓度,剩下的蛋白样品按照3:1比例,混合蛋白样品和SDS-PAGE上样缓冲液。100℃沸水浴加热5 min,以充分变性蛋白。冷却至室温后,4℃,10000 g离心5 min分离上清,可直接上样到SDS-PAGE胶加样孔或分成数管保存在-20℃或-80℃。
免疫印迹 (Immunoblotting) 又称蛋白质印迹 (Western blot, WB),是一种综合性的免疫学检测技术。它利用 SDS-PAGE 技术将生物样品中的蛋白质分子按分子量的大小在凝胶上分离开,然后用电转移的方法将蛋白转移到固相膜上,以固相膜上的蛋白质作为抗原,与对应的抗体起免疫反应,再与酶标记的第二抗体起反应,经过底物显色或荧光成像等方法以检测电泳分离的特异性目的基因表达的蛋白质。
一、电泳:
-
根据目标蛋白的分子量(MW)配置SDS-PAGE胶。(按照本文提出的建议和凝胶配方配制)
Tip a :Tris-tricine gel比 Tris-glycine gel更好的分离低分子量蛋白 (<10kDa)。
Tip b :梯度胶可以提供更清晰的条带,在一种凝胶上提供更大的蛋白检测范围,如10-500kDa。
-
在EP管中制备样品。添加SDS-PAGE 蛋白上样缓冲液 (4×) (Cat No : PR20003),使每个样品的总蛋白质量为30-50μg(根据Bradford或BCA蛋白质分析测定的蛋白质量)。
-
使用涡旋仪混合样品,然后加热至95-100℃,5分钟。
-
将凹槽中残留的胶清理干净,放置在电泳槽中,加入稀释好的SDS-PAGE 电泳液 (1x)(Cat No. PR20004)。
二、蛋白转移(以湿转为例):
-
推荐使用PVDF膜(只有当目标蛋白分子量<20kDa时,使用0.22μm孔径的PSQ膜)。将膜在甲醇中浸泡30秒,用超纯水冲洗两遍,然后用Western Blot 湿法转膜液(Cat No. PR20010)浸泡。将滤纸和海绵也浸泡在转膜液中。
-
将胶从电泳槽中取出,浸泡在转膜液中。
-
以海绵/滤纸/膜/胶/滤纸/海绵的方式,将其紧密排列,确保各个夹层之间没有气泡。
-
采用恒流法(一般是200mA,90min)进行电转。
-
转移完成后,将膜取出,用超纯水冲洗两遍,放入Western Blot 封闭液(Cat No. PR20011)中进行封闭,室温两小时或4℃过夜。
Tip c:如果目标MW大于150kDa,建议4°C湿转过夜,而且最好在转移缓冲液中添加0.005%SDS以便更好的转移大分子蛋白。
Tip d:如果需要观察蛋白转移情况,可用丽春红染膜,观察完用TBST清洗干净。
三、免疫印迹:
-
将膜从封闭液中取出,用1x TBST洗膜三次,每次5分钟。
-
根据推荐稀释度用抗体稀释液(Cat No. PR20013)稀释一抗,37℃孵育1小时或4°C过夜。
-
用1xTBST清洗膜三次,每次10分钟。
-
根据推荐稀释度稀释二抗,将膜放入其中孵育,37℃孵化1小时 。
-
用1xTBST清洗膜三次,每次10分钟。
-
用超纯水将膜冲洗两遍。
Tip e:在实验过程中的任何阶段都要保持膜的润湿状态。
四、曝光:
-
将ECL化学发光检测试剂盒(Cat No. PK10002)中的ECL底物A液和B液1:1混匀后使用。
-
将ECL底物和膜充分反应后,用保鲜膜将膜包裹固定在暗夹上。
-
将膜暴露于暗照相膜或使用化学发光成像仪读取。
Tip f:根据多次曝光时间来确定最佳曝光时间。 -
在曝光后的胶片上备注信息,如:曝光时间,泳道和样品名称。
五、相关试剂配方
|
4x SDS-PAGE 蛋白上样缓冲液(Cat No. PR20003) |
|
|
1 M Tris•HCl (pH 7.0) 母液 |
150 ml |
|
甘油 |
250 ml |
|
SDS |
120 g |
|
溴酚蓝 |
0.4 g |
|
用超纯水补足体积到800ml, 分装 -20°C保存。 |
|
|
湿法转膜液(Cat No. PR20010) |
|
|
Tris |
2.9 g |
|
甘氨酸 |
14.5 g |
|
乙醇 |
200 ml |
|
用超纯水将体积补足到1000ml |
|
|
半干转缓冲液(用于Tris-Tricine胶转移)(Cat No. PR20008) |
|
|
Tris |
36.3 g |
|
醋酸 |
6 ml |
|
甲醇 |
200 ml |
|
用超纯水将体积补足到1000ml |
|
六、SDS-PAGE 胶配方
1. 常规胶配方
对于常规的大于10kDa蛋白,使用以下SDS-PAGE胶配方制备,根据分子量大小选择合适的胶浓度。配方如下:
|
分离胶(10 ml) |
||||
|
目的蛋白分子量 (kDa) |
80-200 |
25-100 |
20-40 |
10-25 |
|
胶浓度 |
8% |
10% |
12% |
15% |
|
ddH₂O |
3 |
2.5 |
2 |
1.25 |
|
40% 丙烯酰胺母液 |
2 |
2.5 |
3 |
3.75 |
|
2x 分离胶缓冲液母液 |
5.0 |
5.0 |
5.0 |
5.0 |
|
10% 过硫酸铵母液 |
0.1 |
0.1 |
0.1 |
0.1 |
|
TEMED |
0.01 |
0.01 |
0.01 |
0.01 |
|
浓缩胶 |
4 ml |
6ml |
8ml |
|
目的蛋白分子量 (kDa) |
- |
- |
- |
|
胶浓度 |
4% |
4% |
4% |
|
ddH₂O |
1.6 |
2.4 |
3.2 |
|
40% 丙烯酰胺母液 |
0.4 |
0.6 |
0.8 |
|
2x 浓缩胶缓冲液母液 |
2.0 |
3.0 |
4.0 |
|
10% 过硫酸铵母液 |
0.04 |
0.06 |
0.08 |
|
TEMED |
0.004 |
0.006 |
0.008 |
|
2x 分离胶缓冲液 (1000ml) |
|
|
Tris |
90.8 g |
|
SDS |
2.0 g |
|
充分溶解后,用浓盐酸将PH调到8.8,然后用超纯水将体积补足到1000 ml。 |
|
|
2x 浓缩胶缓冲液 (1000 ml) |
|
|
Tris |
30.3 g |
|
SDS |
2.0 g |
|
充分溶解后,用浓盐酸将PH调到6.8,然后用超纯水将体积补足到1000 ml。 |
|
|
1x SDS-PAGE电泳缓冲液 ( 1000 ml)(Cat No. PR20004) |
|
|
Tris |
3.03 g |
|
甘氨酸 |
18.75 g |
|
SDS |
1 g |
|
充分溶解后,用超纯水将体积补足到1000ml。 |
|
2. Tris-Tricine 胶配方
对于分子量小于10KDa的,建议使用Tris-Tricine胶体系。配方如下:
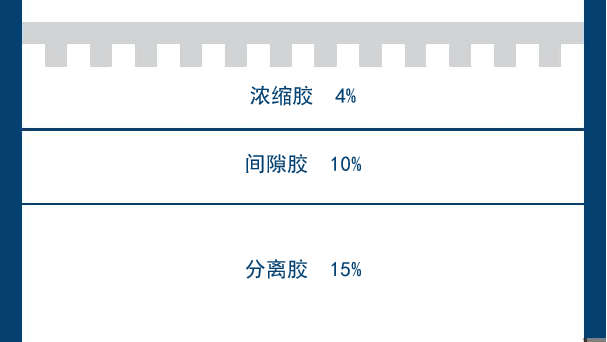
|
Reagents |
浓缩胶 |
间隙胶 |
分离胶 |
|
胶浓度 |
4% |
10% |
15% |
|
体积 |
2 ml |
1.5 ml |
6 ml |
|
37% 甘油母液 |
- |
- |
1.63 ml |
|
ddH₂O |
1.51 ml |
0.595 ml |
- |
|
40% 丙烯酰胺母液 |
0.2 ml |
0.375 ml |
2.25 ml |
|
3M Tris HCl (pH 8.5)母液 |
- |
0.5 ml |
2.0 ml |
|
1M Tris HCl (pH 6.8)母液 |
0.25 ml |
- |
- |
|
10% SDS母液 |
0.02 ml |
0.15 ml |
0.06 ml |
|
10% APS母液 |
0.02 ml |
0.015 ml |
0.06 ml |
|
TEMED |
0.002 ml |
0.0015 ml |
0.003 ml |
|
1x Tris-Tricine阴极电泳缓冲液 ( 1000ml) |
|
|
Tris |
12.1 g |
|
Tricine |
17.9 g |
|
SDS |
1 g |
|
充分溶解后,用超纯水将体积补足到1000 ml。 |
|
|
1x Tris-Tricine阳极电泳缓冲液 ( 1000ml) |
|
|
Tris |
24.23g |
|
充分溶解后,用浓盐酸将PH调到8.9,然后用超纯水将体积补足到1000ml。 |
|
免疫化学( Immunochemistry),包含免疫组织化学( Immunohistochemistry, IHC)和免疫细胞化学( Immunocytochemistry, ICC),是利用抗原与抗体之间的结合具有高度特异性的原理,通过抗原抗体结合及呈色反应,显示组织或细胞中的化学成分,对组织切片或细胞标本中某些化学成分进行定性、定位或者定量研究。
Proteintech可提供2000余种即用型免疫组化试剂盒(IHCeasy kit)。IHCeasy kit 旨在提供染色组织样本所需的所有抗体和试剂,包括一抗。每个试剂盒的方案都经过了彻底优化,为您感兴趣的蛋白质提供最佳染色结果。试剂盒中的试剂均为即用型,您只需将它们直接应用于组织样本,即可获得高质量的IHC数据。(点击查看全部IHCeasy kit产品列表)
-
在二甲苯(Ⅰ)中20min,在二甲苯(Ⅱ)中20min; 在无水乙醇(Ⅰ)和(Ⅱ)中各浸泡5min; 95%乙醇中浸泡5min; 80%乙醇中浸泡5min; 60%乙醇中浸泡5min; 单蒸水或去离子水中浸洗3次,每次1min。
-
取一定量的修复液于一耐高温容器里,将切片放入其中,再将容器放进微波炉中,power5或中火加热10min。
-
或者是在烧杯中加入一定量修复液于电炉上加热至沸腾,将切片置于切片架上放入加热的修复液中继续煮沸15min。完毕,放在室温自然冷却,30-40min后,降至室温。
- Proteintech 可提供柠檬酸钠抗原修复液(Cat No. PR30001),Tris-EDTA 抗原修复液(Cat No. PR30002),蛋白酶K抗原修复液(Cat No. PR30014),满足不同样本的修复需求。推荐根据抗体说明书来选择合适的修复液。
-
取出切片,在单蒸水或去离子水中浸洗3次,每次1min;
-
洗净后,将切片浸入装有3%双氧水溶液的容器中,盖上盖子,室温密闭下,浸泡10min;
-
取出切片,在单蒸水或去离子水中浸洗3次,每次1min;
-
甩干,擦净,滴加适量3%BSA,室温湿盒封闭1hour;
-
用吸水纸吸去多余液体(注意不要干片),滴加适量稀释好的一抗(一抗用抗体稀释液稀释 Cat No. PR30003),室温湿盒孵育1hour或4℃过夜;
-
1xTBS冲洗4-5次,每次30sec;
-
甩干,擦净,滴加适量二抗,室温湿盒孵育30min;
-
1xTBS冲洗4-5次,每次30sec;
-
甩干,擦净,滴加适量DAB溶液(Cat No. PR30010),2-5min后迅速用单蒸水或去离子水冲洗干净;(DAB工作液现配现用)
-
甩干,擦净, 滴加1滴Mayor's苏木精,复染1.5-2min,在TBS溶液中浸泡5-10min;
-
取出切片,在单蒸水或去离子水中浸洗3次,每次1min;
-
梯度酒精及二甲苯脱水:分别在60%,80%,95%酒精中浸泡5分钟,再在无水乙醇(Ⅰ)和(Ⅱ)中各浸泡5min,然后在二甲苯(III)和(IV)中各浸泡5分钟;
-
从二甲苯(IV)中取出切片,中性树胶封片,镜检。
免疫荧光(Immunofluorescence, IF)染色是一种广泛应用于生物学研究和临床诊断的技术。IF利用荧光标记抗体检测特异性靶抗原。染色成像非常直观,可以直接观察结果。虽然这是一个成熟的技术,但必须考虑多个因素,并采取各种优化步骤,以确保染色成功。
实验步骤:
一、样本处理:
细胞爬片
-
在培养板中将已爬好细胞的玻片用PBS快洗3次,推荐使用PBS磷酸盐缓冲液(Cat No. PR20014)或超低内毒素PBS(Cat No. PR40008)。
-
在4%多聚甲醛或其他固定液(免疫染色固定液,Cat No. PR30006)常温固定20 min,PBS洗三次,每次3 min。
-
在0.1% Triton X -100室温通透(免疫染色通透剂,Cat No. PR30007)10 min,PBS洗三次,每次3 min。吸取培养基,用1X PBS清洗接种在干净盖玻片上的细胞。
冰冻切片
-
冰冻切片放置PBS里室温平衡10-20 min。
-
在4%多聚甲醛常温固定30 min,PBS洗三次,每次3 min。
-
在0.2% Triton X-100室温通透15 min,PBS洗三次,每次3 min。
石蜡切片
-
脱蜡:请参考IHC操作步骤
-
抗原修复:取适量的Tris-EDTA(pH9.0)、EDTA(pH8.0)或者柠檬酸(pH6.0)于烧杯中(修复液能没过切片架即可),盖上盖子,待修复液煮沸后,将切片放入其中,盖上盖子,继续煮沸修复液15 min。通风厨中自然冷却。
-
取出切片,在单蒸水或去离子水中浸洗3次,每次3min。
二、封闭:
-
在1X PBS中制备5%正常血清的封闭溶液。从产生第二抗体的同一物种中选择血清,例如,如果第二抗体是山羊抗小鼠,则应选择山羊血清作为封闭液。
-
将细胞与封闭溶液孵育1小时(或者,如果没有相应的血清,则使用1X PBS中的3%BSA进行封闭。)
三、抗体孵育:
-
吸取封闭液,在抗体稀释缓冲液中稀释一抗。设置空白对照(在不加一抗的抗体稀释缓冲液中培养)。常温孵育1小时,或者,在4°C的温度下孵育过夜.
-
请注意:如果隔夜孵育,请采取措施确保盖玻片不会变干。
-
用1X PBST清洗样本3次,每次5分钟。
-
加入用抗体稀释缓冲液稀释的适量的荧光二抗,并在潮湿、黑暗的环境中室温孵育1小时。
-
请注意:加入荧光二抗后,实验样本必须尽可能保持在黑暗条件下。
-
用1X PBST(0.1%Tween)清洗样本3次,每次5分钟。
四、封片和镜检:
-
用含DAPI(如果需要)的封片剂将样本封固在载玻片上。
-
在荧光显微镜下检查载玻片。
免疫沉淀(Immunoprecipitation ,IP )是利用抗体抗原特性性结合的一种亲和纯化技术,广泛应用于从组织或细胞裂解物中富集、分离天然靶蛋白。
注意:操作样品尽量冰上或4℃进行。
一、样品准备
-
可选择与您研究材料相匹配的标准操作流程进行细胞裂解。也可参考Proteintech官网“细胞与组织裂解物制备”操作。
Tip 1:高浓度的去垢剂会干扰免疫沉淀效果。所以可先用小体积RIPA(Cat No. PR20001)裂解细胞制备蛋白裂解物,在开始IP捕获前,再补加1 X PBS或孵育液稀释到需要的体积。
Tip 2:使用足量的蛋白裂解物:单管IP实验,推荐裂解物初始体积为0.2–0.4 ml, 含1–3 mg总蛋白。可采用Bradford 或BCA法测定总蛋白浓度。
Tip 3:确保裂解液中添加了蛋白酶抑制剂(Cat No. PR20016),蛋白酶抑制剂用量可以是正常WB实验制样的1.5-2倍。
裂解物预处理(可选) -
以45°角剪掉已灭菌枪头的末端,快速吸取重悬的Protein A sepharose beads(Cat No. PR40023)悬液,加入含有裂解物的EP管中。通常1-3mg总蛋白裂解物需加入30μl重悬的Protein A sepharose beads悬液。
-
4 ℃旋转孵育60min(推荐用垂直旋转混合仪,低速旋转)。
-
4 ℃、500g 离心1min,将上清转入新的EP管中。
Tip 4:对于富含IgG的组织,推荐用Protein A beads或Protein G beads(Cat No. PR40024)预处理步骤。
二、免疫沉淀
-
吸取含有1-3mg总蛋白的裂解物(或预处理)200-400μl,加入EP管中,同时加入1-4μg特异性抗体以及 150-300μl 孵育液,最佳抗体数量应由抗体效价决定。另取等量蛋白裂解物,加入等量孵育液和等量同型IgG孵育作为Control IgG对照组。4℃ ,旋转2–4h或过夜。
-
然后加入50μl重悬的 Protein A 琼脂糖珠 ,4℃ 旋转孵育1-4h。
-
4 ℃、500g 离心30s,弃上清。
-
每次用1mL 1× TBST(现加蛋白酶抑制剂(Cat No. PR20016))洗涤沉淀复合物,4℃、500g 离心30s,吸弃上清;重复洗涤4-5次。最后一次洗涤/离心结束后,EP管中保留约80 ul 溶液(其余都吸弃)。
-
加20μl 5x SDS Sample Buffer,重悬IP复合物beads,95–100℃ 沸水浴 5min , 然后8,000-10,000g 离心3min, 小心吸取上清转入新的EP管中。
三、WB 分析
-
将收集的IP样品加入SDS-PAGE对应泳道, 同样可以将剩余IP样品于-80℃保存备用。
-
通过SDS-PAGE分离IP样品,并将蛋白质向PVDF膜转移。使用合适抗体进行后续检测。
四、如何选择检测二抗
| IP捕获抗体类型 | WB检测时一抗类型 | WB检测时二抗类型 | 备注说明 |
| 小鼠单抗/多抗 | 小鼠单抗 | HRP-标记Protein A 或HRP一标记抗小鼠IgG二抗 |
WB 检测时一般的HRP-标记抗小鼠 IgG 二抗可产生严重的重链轻链干扰信号;HRP-标记 Protein A 可以有效降低重链信号强度,消减轻链信号;WB一抗若为 mouse IgG1/IgG3 亚型,HRP-标记 Protein A亲和力较低,可适当降低其稀释度(也可先尝试HRP-标记抗小鼠IgG二抗);WB一抗若为小鼠 IgM/IgA 亚型,则避免选择 HRP-标记 ProteinA,因其不结合。 |
| 小鼠多抗 | |||
| 兔抗 | HRP-标记抗兔IgG二抗 | 由于 IP 捕获抗体与 WB 检测一抗属于不同种属来源抗体,故WB检测时使用 HRP-标记抗兔 IgG二抗可以有效避免重链轻链信号的影响。 | |
| 兔抗 | 小鼠单抗 | HRP-标记抗小鼠IgG二抗 | 由于IP捕获抗体与WB检测一抗属于不同种属来源抗体,故WB检测时 使用HRP-标记抗小鼠IgG二抗可以有效避免重链轻链信号的影响。 |
| 小鼠多抗 | |||
| 兔抗 | 1、HRP-标记Protein A 2、HRP-标记抗兔IgG轻链特异性抗体 |
1、WB检测时HRP-标记抗兔IgG二抗会产生很强的重链轻链信号,以及背景信号,对结果分析有一定影响; 2、HRP-标记Protein A可以有效降低重链信号以及消减轻链信号的影响,背景干净,适用于检测目的蛋白大小除45-55 kDa之外的所有目的蛋白,而目的蛋白大小在45-55 kDa之间时,推荐使用HRP-标记抗兔IgG轻链特异性二抗。 |
五、相关溶液
|
RIPA裂解液(Cat No. PR20001) |
配:1000 ml |
|
Tris |
6 g |
|
NaCl |
8.76 g |
|
脱氧胆酸钠 |
5 g |
|
SDS |
1 g |
|
NaF |
0.42 g |
|
EDTA.2Na.2H2O |
1.86 g |
|
Triton X-100 |
10 ml |
|
盐酸调pH至7.4,补ddH₂O定容至1000 ml,4℃保存 |
|
|
注:PMSF及其它蛋白酶抑制剂现用现加 |
|
|
5x SDS sample buffer |
For 50 ml |
|
Tris HCl (1M母液,pH 7.0) |
12.5 ml |
|
甘油 |
17.5 ml |
|
SDS |
7.5 g |
|
溴酚蓝 |
15 mg |
|
补ddH₂O至37.5 ml, 分装并保存在-20℃ |
|
|
现用现加还原剂:25% ß-巯基乙醇或25% DTT(2M母液) |
|
|
孵育液 |
配: 1000 ml |
|
KCl |
0.2 g |
|
KH2PO4 |
0.2 g |
|
Na2HPO4·12H2O |
1.14 g |
|
NaCl |
8 g |
|
NaF |
0.42 g |
|
EDTA.2Na.2H2O |
1.86 g |
|
使用1M或2M的NaOH调节pH至7.4,补ddH₂O定容至1000 ml,4℃保存 |
|
染色质免疫沉淀(ChIP)是一种研究蛋白质与染色质DNA相互作用的技术,根据不同目的既可用于鉴定互作蛋白,也可用于鉴定互作DNA。通常被用于表观遗传学研究,如通过ChIP检测转录调节相关的组蛋白修饰。
操作步骤:
- 对于悬浮细胞, 确保10 ml新鲜培养基中有合适数量的细胞,直接加37%甲醛至终浓度为1%。摇晃混匀后,室温下摇床孵育10 min。
- 对于组织, 液氮充分研磨组织至粉末状。然后转移至15 ml或50 ml尖底管中,加入10 ml PBS和 270 μl 37%甲醛至终浓度为1%。摇晃混匀后,室温下摇床孵育10 min。
-
加入500 ul 2.5 M甘氨酸(至终浓度0.125 M)终止反应,室温孵育5 min。
-
细胞转至50 ml尖底管中,4℃、2500 rpm离心5 min。
-
弃上清,冰预冷PBS(pH 7.4)洗涤细胞2次,每次洗涤后4℃、2500 rpm离心5 min。
-
用1 ml冰预冷细胞裂解液(Cat No. PR20001,现加蛋白酶抑制剂(Cat No. PR20016)),重悬细胞。为促进细胞膜的破裂,用Douncer玻璃匀浆器匀浆细胞5~10次,4℃孵育15 min。
-
4℃、4000 rpm离心5 min,弃上清。
-
细胞裂解液重新细胞核 (每3-5 x 106 个细胞加100 ul裂解液)。
-
冰上超声5~15 min(25%功率,超声20s、停30s),最佳超声条件需要根据预实验确定。
-
4℃、12000 rpm离心5 min,转移上清至新EP管中,直接进行后续试验,或冻存-20℃备用。
-
取50 ul染色质上清,加入150 ul ddH2O,10 ul 5M NaCl,65 ℃ 4 h或过夜,解交联。
-
加入RNaseA至终浓度50 μg/ml,37 ℃孵育30 min。
-
加入Proteinase K至终浓度50 μg/ml,42 ℃孵育30 min。
-
剂盒纯化DNA片段。
-
1.5 %琼脂糖胶电泳检测。
-
准备70 ul磁珠。
-
用600 μl含5 %BSA的PBS,洗涤磁珠2次。
-
第二次洗涤后,重悬磁珠至初始体积。
-
取100 ul细胞裂解物(约含20 ug 染色质,具体因细胞及制样不同而异),1:10稀释至1 ml。
-
取25 ul洗好的磁珠,加至细胞裂解物中,进行lysate 预吸附处理。
-
剩余45 ul磁珠,加入2-5 ug相应抗体,4 ℃旋转孵育过夜。(使用非特异性的IgG,作为阴性抗体对照)。
-
将步骤5 中样品,磁性分离,转移预吸附后的lysate至新EP管中。
-
用300 ul 冰预冷的 PBS(含5% BSA),洗涤步骤6后的抗体-磁珠复合物2次,弃上清。
-
加入预吸附后的lysate(留50 ul冻存备用)至抗体-磁珠复合物中,4 ℃旋转孵育2 h。
-
瞬离样品,然后置于磁力架上。
-
每次1 ml低盐洗涤液,洗涤2次。
-
每次1 ml高盐洗涤液,洗涤2次。
-
每次1 ml LiCl洗涤液,洗涤2次。
-
每次1 ml TE溶液,洗涤2次。第2次洗涤时,转移样品至新EP管中。
-
最后洗涤结束,移液器尽弃洗涤液。
-
准备Elution buffer,恒温浴调至65 ℃。
-
加入100 ul Elution buffer至每个样品中(步骤15后),65 ℃孵育10 min。
-
转移洗脱液至新EP管,并重复步骤17一次,最终收集到200 ul。
-
取之前预吸附后的lysate 50 ul,作为 5% Input。补加150 ul Elution buffer,至总体积200 ul。
-
分别向CHIP洗脱样品(步骤18后)和Input中加入10 ul NaCl(5 M 母液),65 ℃孵育过夜进行解交联。
-
加入Proteinase K至终浓度50 μg/ml,42 ℃孵育1 h。
-
试剂盒纯化DNA片段。
-
PCR检测及分析。
流式细胞技术( Flow Cytometry, FC)是一种对液流中排成单列的细胞或其它生物微粒(如微球、细菌、小型模式生物等)逐个进行快速定量分析和分选的技术。
-
制备单细胞悬液;
-
PBS洗涤两次后加入固定剂;
(1)靶标在胞内时加入4%PFA固定10-20分钟后,用Flow Cytometry Perm Buffer洗涤1-2次(每次5分钟,400-600g);
(2)靶标在核时加入Transcription Factor Staining Buffers。(固定30-60分钟,洗涤1-2次,每次5分钟,400-600g); -
洗涤之后加入对应的缓冲液,重悬细胞静置10分钟;
-
[可选]阻断Fc受体(10-20分钟);
-
加入抗体,2-8°C孵育(30分钟);
-
用对应的缓冲液洗涤1-2次(每次5分钟,400-600g);
-
如非荧光染料直标抗体加入荧光二抗,2-8°C孵育(30分钟);
-
用对应的缓冲液洗涤1-2次(每次5分钟,400-600g);
-
[可选]细胞活性染料染色细胞;
-
用对应的缓冲液(或PBS)重悬细胞;
-
利用流式细胞仪分析细胞。
-
制备单细胞悬液;
-
[可选]阻断Fc受体(10-20分钟);
-
加入抗体,2-8°C孵育(30分钟);
-
用流式细胞染色缓冲液(或PBS)洗涤(1-2x5分钟,350g);
-
如非荧光染料直标抗体加入荧光二抗,2-8°C孵育(30分钟);
-
用流式细胞染色缓冲液洗涤(1-2x5分钟,350g);
-
[可选]细胞活性染料染色细胞;
-
用流式细胞染色缓冲液(或PBS)重悬细胞;
-
利用流式细胞仪分析细胞。
|
10X PBS |
1000 ml |
|
KH2PO4 |
2.4 g |
|
NaH2PO4·12H2O |
37.2 g |
|
NaCl |
80 g |
|
KCL |
2 g |
|
ddH2O |
1000 ml |
|
pH |
7.2-7.4 |
酶联免疫吸附试验( Enzyme Linked Immunosorbent Assay, ELISA)是目前应用最广泛的免疫学检测技术,是将抗原 - 抗体反应的特异性与酶催化作用的高效性相结合,通过酶作用于底物后的显色反应判定结果。一般用酶标测定仪测定吸光度( OD 值)来反映抗原或抗体含量,灵敏度可达每毫升纳克( ng)水平甚至皮克( pg)水平。由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
目前常用的 ELISA 方法有直接法、间接法、双抗夹心法、竞争法 ELISA。此处介绍双抗夹心 ELISA 操作步骤。
ELISA实验步骤:
-
ELISA包被液 (5×) (Cat No. PR10006)
-
ELISA洗涤液 (20x)(Cat No. PR10007)
-
封闭液:PBST+5%脱脂奶粉
-
ELISA通用稀释液 (5x)(Cat No. PR10008)
-
一抗
-
酶标二抗
-
TMB显色液(Cat No. PK10004,A液) :
| 无水乙酸钠 | 27.2 g |
| 柠檬酸 | 3.2 g |
| 30%过氧化氢 | 0.6 ml |
| 定容至1 L | |
-
TMB显色液(Cat No. PK10004,B液):
| 乙二胺四乙酸二钠 | 0.4 g |
| 柠檬酸 | 1.9 g |
| 四甲基联苯胺 | 0.3 g |
| 二甲基亚砜 | 6 ml |
| 甘油 | 100 ml |
| 定容至1 L | |
- ELISA实验开始前,各试剂均应平衡至室温(试剂不能直接在37℃溶解)。试剂或样品稀释时,确保混匀,同时尽量避免起泡。
- 包被抗体:用碳酸盐缓冲液(CBS)或者磷酸盐缓冲液(PBS)根据实验需要,将包被抗体稀释到一定的稀释度,100 μL/孔包被,37℃、2 h或者4℃过夜。
- 洗板:弃孔内液体,甩干,10 mM PBST(10 mM PBS+0.05% Tween-20)洗板2次,每次浸泡1-2 min,350 μL/孔,甩干(也可以轻拍将孔内液体拍干)。
- 封闭:含1% BSA或者5%脱脂牛奶的10 mM PBST(10 mM PBS+0.05% Tween-20)做封闭液,350-400 μL/孔,37℃、2 h。
- 洗板:同步骤2。(备注:商品化试剂盒一般已经预包被了包被抗体在酶标板上,不需要进行1-4步骤,使用前请注意核实)。
- 加样:分别设零孔、标准孔、待测样品孔。空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL。(注意不要有气泡,加样将样品加于酶标板孔底部,尽量不触及孔壁,一块板要在10 min内上完样品。)酶标板加上盖或覆膜,37℃反应60-120 min。为保证实验结果有效性,每次实验请使用新的标准品溶液。
- 洗板:弃孔内液体,甩干,10 mM PBST(10 mM PBS+0.05% Tween-20)洗板4次,每次浸泡1-2 min,350-400 μL/孔,甩干(也可以轻拍将孔内液体拍干)。
- 加检测抗体:根据实验需要,将检测抗体用PBST稀释到一定的稀释度,100 μL/孔,37℃、1 h。
- 洗板:同步骤6。
- 加二抗:根据实验需要,将二抗用10 mM PBST稀释到一定的稀释度,100 μL/孔,37℃、1 h。
- 洗板:同步骤6。
- 酶标仪读值:以630 nm为校正波长,用酶标仪在450 nm波长依序测量各孔的吸光度(OD值),在加终止液后5 min内进行读数。
- 结果判断:
- 每个标准品和样本的OD值须减去零孔的OD值,如设置复孔,则应取其平均值;
- 以标准品的浓度为横坐标,OD值为纵坐标,使用专业制作曲线软件进行四参数拟合(4-PL),如Origin、ELISACalc等,根据样品的OD值由标准曲线推算出相应的拟合浓度,再乘以稀释倍数即为样本的测定浓度。
抗原亲和纯化(Affinity-Purification )是基于抗原 - 抗体可逆结合的特性产生的一种纯化免疫球蛋白的方法,通过交联到树脂上的抗原,纯化出与抗原有特异性反应的抗体,这一纯化方法大量的去除了非特异性的免疫球蛋白成分,得到的抗体特异性更高。
抗原亲和柱制备
-
CNBr-activated Sepharase 4B,GE Healthcare
-
1mM HCL
-
1L连接缓冲液
| 100mM NaHCO3 | 8.4 g |
| 500mM NaCl | 29.2 g |
| 加ddH2O至1L | |
-
封闭液: 0.5M 乙醇胺,0.5M NaCl pH 8.0
-
pH4.0洗涤液:
| 0.5M NaCl | 19.22 g |
| 加ddH2O至1L,加醋酸调pH至4.0 | |
-
pH8.0洗涤液:
| 0.1M Tris | 121.1 g |
| 加ddH2O至1L,加盐酸调PH至8.0 | |
-
PBS缓冲液:
| 10mM Na2HPO4·12H2O | 3.58 g |
| 1.8mM KH2PO4 | 0.24 g |
| 137mM NaCl | 8 g |
| 2.7mM KCl | 0.2 g |
| pH 7.4,加ddH2O至定容至1L | |
-
预处理 CNBr-activated Sepharase 4B:称取适量 CNBr-activated Sepharase 4B干粉( 1mg冻干粉可得到3.5mlbeads,通常1mlbeads能结合5-10mg蛋白),放入预冷1mM HCL的烧杯中置于4度15分钟。等体积分装beads于亲和纯化柱中,按照1ml beads 200ml1mM HCL洗涤。然后抽干残留HCL。
-
将溶解处理好的蛋白或是多肽加入适量coupling buffer,然后加入装有beads的纯化柱。同时在两种条件下孵育:室温孵育3-4小时,4度孵育过夜。
-
孵育结束后用coupling buffer洗涤连接好的beads3次,然后加入封闭液,1mlbeads加8ml封闭液。4度过夜或是室温4小时。
-
流出封闭液,用coupling buffer洗涤3次后,分别用PH4.0和PH8.0的酸碱交替洗涤3次。
-
洗好的beads加入20%乙醇的PBS放4度备用。
亲和纯化步骤
一、物料和试剂
-
PBS缓冲液:
| 19.38mM Na2HPO4·12H2O | 69.4 g |
| 1.8mM KH2PO4 | 2.4 g |
| 121.24mM NaCl | 70.9 g |
| 调pH至7.84,定容至10 L | |
-
磷酸中和液:
| Na2HPO4·12H2O | 322.3 g |
| KH2PO4 | 4.9 g |
| 加水定容至1 L | |
-
洗脱液:
| 150mM NaCl | 87.6 g |
| HCL调pH至2.0-2.5, 定容至10 L | |
-
考马斯亮蓝:100mg 考马斯G-250,50ml 乙醇,100ml 磷酸。
-
4℃解冻血清后,浸入56度水浴锅30分钟,保证血清液面在水浴里面。
-
4℃,3500rpm,离心20分钟。
-
用移液器将离心好的血清表面的脂类吸出,取上清,留30-50ul血清小样ELISA检测。
-
将准备好的柱子和血清进行孵育,室温1.5小时,室温低时可置于30℃水浴锅。
-
孵育完成后用PBS洗涤3次,每次10倍柱体积。
-
洗脱:用pH5.0的150 mM甘氨酸预洗脱5-10ml,再用预冷的pH2.5洗脱液洗脱,每次收集1ml,EP管或是96孔收集板中预先加入50ul中和液。
-
将收集液用考马斯检测收集峰,100 ul考马斯中加入3.3 ul收集液,并根据收集峰判断直接收集和需要浓缩的抗体,并分开保存。
-
考马斯检测没有颜色的时候终止收集,用10 mlPBS洗涤,然后重复孵育洗脱直到没有收集峰出现。取50 ul FT留样做ELISA 。
-
将收集的低浓度抗体用PEG浓缩或是ProA浓缩。
-
按要求保存抗体.
-
将菌体用30-35 ml PBST 悬浮;
-
冰浴超声:300W, 2s, 2s, 6 min;
-
破碎后离心:12000rpm,15 min,4℃;
-
将沉淀用30 ml wash buffer重悬,添加200 ul (100 mM)PMSF ,60 ul (2 M)DTT;
-
冰浴超声:300 W, 2s, 2s, 3min;
-
室温振荡洗涤1h;
-
离心:10000 rpm, 10 min,4℃;
-
沉淀再用15ml wash buffer 重悬,冰浴超声:300W,2s,2s,1min;
-
室温振荡洗涤1h;
-
用10ml的 EP管 离心:10000rpm,10min,4℃;
-
沉淀用纯水清洗。
-
根据蛋白用途,再加入适当体积的溶解液,重悬沉淀,4℃振荡过夜溶解:
注射用:8M Urea pH 8.0纯化用:2% SKL pH 8.0
-
次日离心:10000rpm,10min,4℃,制样跑胶。


